一款创新药,经过实验室里的层层筛选后,还要经历严苛的临床试验,上市前申请,药监药监局审评等关卡才能最终上市,可谓九死一生。今天我邀请到曾在国家药品监督管理局工作的李艺,和在跨国大药企医学部工作的孙天墨来跟大家聊聊创新药的审评与上市。
【我们聊到】
1. 为什么从医生转行进入药品行业?
2. 新药研发都要经过哪些考验?
3. 什么是药品的生命周期?
4. 大药企的医学部都做什么?
5. 临床试验如何进行,谁来监管?
6. 临床试验通过了,如何申请上市?
7. 国内药品审评与国外的一些区别?
8. 三个医学生关于医学教育的一些思考和讨论。
【嘉宾】
李艺 清华大学临床试验中心博士后,曾任职国家药品监督管理局
孙天墨 诺华医学部医学顾问
【英文缩写】
CDE (Center for Drug Evaluation) 国家药品监督管理局
IND (Investigational New Drug) 申请-- 开始临床试验之前的申请
NDA (New Drug Application)--新药上市申请
GCP (Good Clinical Practice)药物临床试验质量管理规范
CRA (Clinical Research Associate) 临床监察员
【附图】
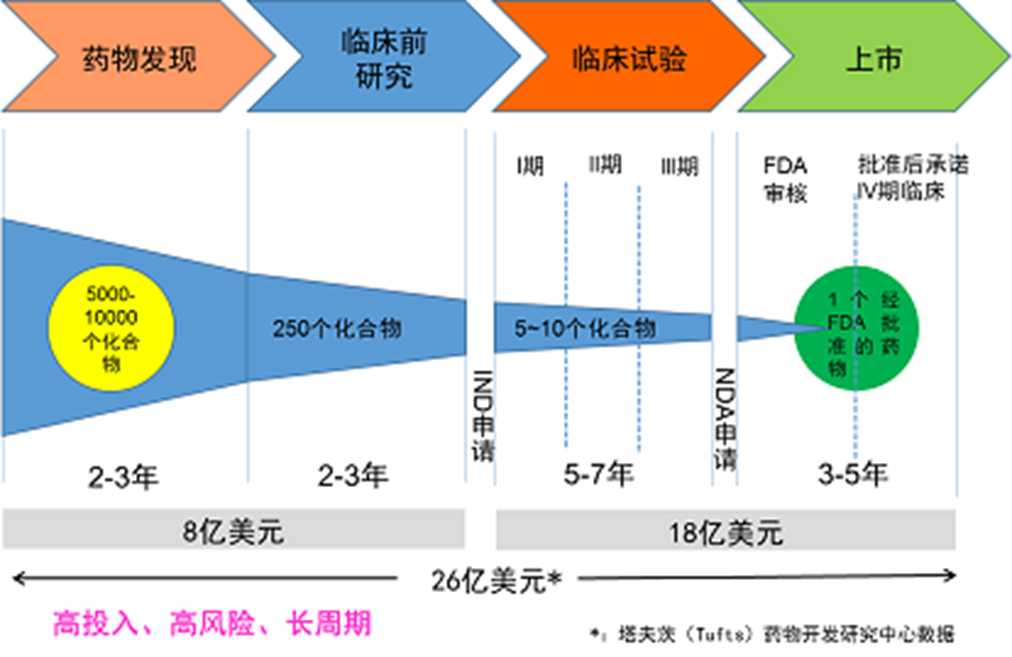
新药研发的环节
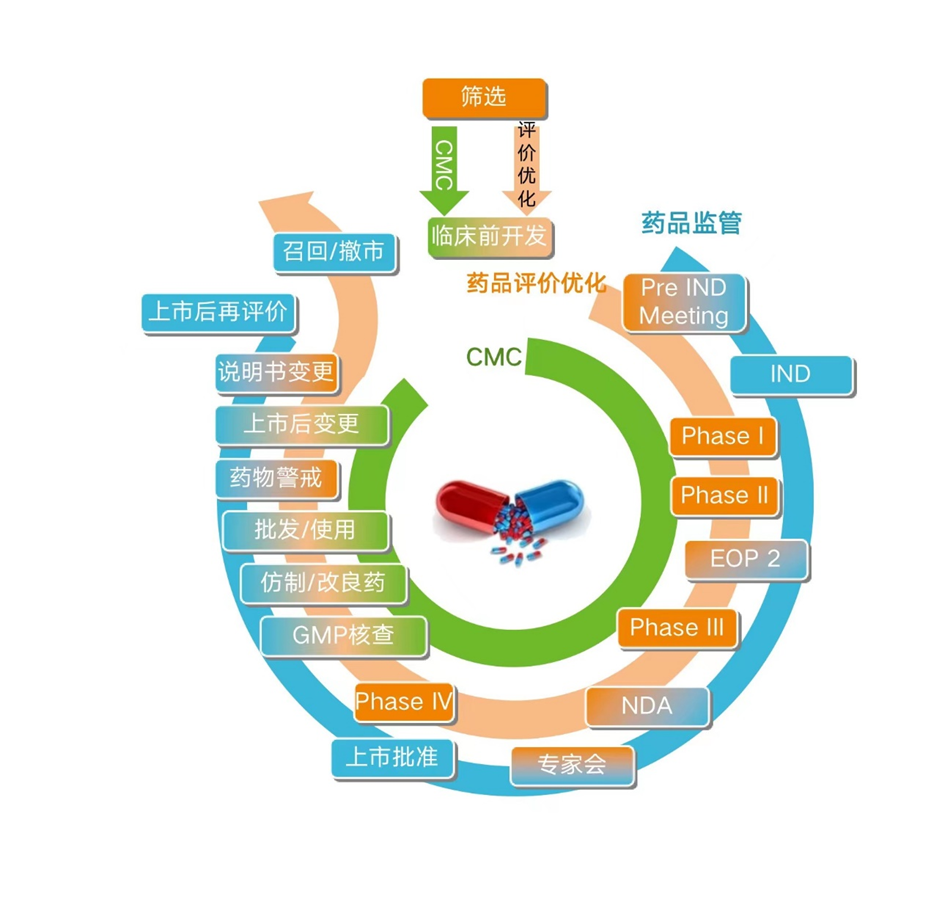
药品的生命周期:


 2184
2184 30
30